Вазопрессин как связующее звено между нарушения сна и проблемами с памятью
Сон является неотъемлемой частью биологических ритмов, и нерегулярный сон и бессонница могут привести к развитию различных заболеваний, включая болезни сердечно-сосудистой системы, опухоли и психиатрические расстройства. Сон оказывает влияние на иммунную систему, проводя консолидацию не только памяти в головном мозге, но и в приобретенном иммунном ответе, а нарушения сна ведут к повышенному риску возникновения инфекционных заболеваний. Бессонница ухудшает процессы формирования кратковременной и долговременной памяти. Поскольку нарушения памяти лежат в основе многих психиатрических заболеваний, то современные исследования направлены на изучение связи нарушений сна с психозами, нейродегенеративными заболеваниями, большим депрессивным расстройством, генерализованным тревожным расстройством, посттравматическим стрессовым расстройством и биполярным аффективным расстройством.
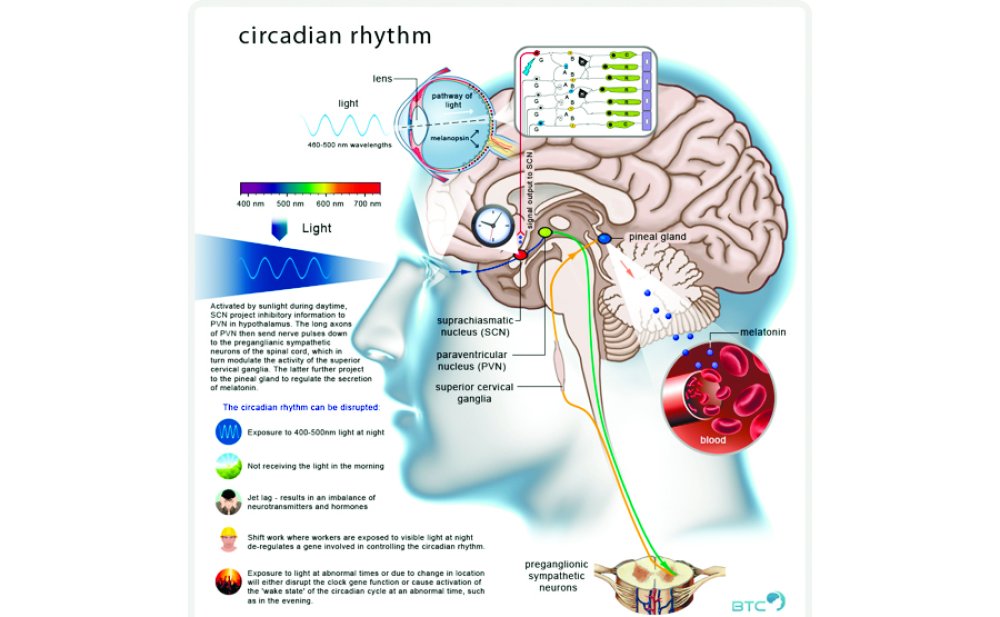
Основным центром циркадных ритмов в головном мозге является супрахиазматическое ядро, а гуморальная регуляция обеспечивается не только мелатонином, который принято считать основным регулятором циркадных ритмов, но и вазопрессином (антидиуретическим гормоном – АДГ), который также играет ключевую роль в формировании памяти. Авторы статьи изучили связь вазопрессина с памятью и нарушениями сна на примерах ряда исследований.
Вазопрессин
АДГ – это гормон, синтезирующийся в головном мозге и выделяющийся в кровь через заднюю долю гипофиза. На периферии он является частью вазопрессинергической системы, отвечающей за регуляцию водно-солевого баланса в организме. Однако в центральной нервной системе (ЦНС) АДГ способен регулировать активность других нейронов, и данная система задействована в формировании циркадных ритмов, тревожности, депрессии, обучении, памяти и социальном поведении. Вазопрессин реализует свое действие через 3 типа рецепторов: V1a, V1b и V2 рецепторы. V2-рецепторы находятся в почках и участвуют в периферической вазопрессинергической системе, тогда как V1b расположены в передней доле гипофиза и участвуют в гипоталамо-гипофизарно-адренокортикальной оси, отвечающей за формирование ответа на стресс. Однако данные V1a-рецепторы также были обнаружены в других областях мозга, таких как миндалина, терминальная полоска, гипоталамус и ствол. У ряда животных данные рецепторы были обнаружены и в коре.
Важно отметить, что АДГ, попадающий на периферию, синтезируется в крупноядерных клетках гипоталамуса, тогда как центральный АДГ в парвоцеллюлярных нейронах и миндалине. Центральный вазопрессин также может синтезироваться и крупноядерными клетками, однако далее он выделяется сразу внутри гипоталамуса, а не идет далее в гипофиз.
Супрахиазматическое ядро – внутренние часы
Ещё 50 лет назад во время исследований поражений ЦНС была обнаружена роль супрахиазматического ядра в регуляции циркадных ритмов: у крыс с повреждением данной области происходили нарушения в питьевом режиме и локомоции, в норме напрямую зависящих от циркадных ритмов. Удаление супрахиазматического ядра приводило к нарушению циркадного синтеза кортикостерона, аналога человеческого кортизола, формирующего в норме адаптацию на стресс.
Первым нейромедиатором, обнаруженным в супрахиазматическом ядре, стал вазопрессин, и дальнейшие исследования в данной области показали его связь с формированием циркадных ритмов. Интрацеребральное введение АДГ мышам увеличило их время бордствования, в то время как препарат-антагонист V1-рецепторов снижал его. У мышей, нокаутных по гену рецептора V1, значительно снижалась зависимая от биологических часов локомоторная активность.
Вазопрессин и сон
Исследования влияния АДГ на людях показали, что системное введение АДГ дозозависимо снижает S2 и REM фазы сна, при этом данный эффект был не зависим от гипоталамо-гипофизарно-адренокортикальной системы и вазопрессорных функций данного гормона.
Однако другое исследование, с участием пожилых пациентов, показало, что интраназальное введение АДГ положительно повлияло на возраст-зависимые нарушения сна, снизив их клиническую выраженность. Кроме того, улучшения сна сопровождалось снижением уровня кортизола. Противоположные результаты двух данных исследований могут быть связаны с различиями в регуляции АДГ у молодых и пожилых пациентов. Например, гены АДГ могут подвергаться эпигенетическим модификациям, что с возрастом будет вести к иному способу регуляции циркадных ритмов.
Вазопрессин и память
Депривация сна снижает когнитивные функции и память. Отсутствие сна в течение ночи снижало способности участников исследования к устному счету и снижало общее количество правильных ответов в контрольных тестах. Кроме того, хроническое снижение количества сна менее 6 часов за ночь создавало когнитивный дефицит и нарушения памяти, эквивалентные 2 ночам полной депривации сна.
Участие АДГ в формировании памяти впервые было описано в 1965 году и последующие исследования подтверждали его роль. Например, повторяющееся интраназальное введение АДГ желтобрюхим полёвкам улучшало их пространственную память.
Гиппокамп, основное место формирования пространственной памяти, является также ключевой областью участия АДГ в этом процессе. Исследования показали, что введение АДГ увеличивало активность клеток зубчатой извилины гиппокампа in vitro. Введение АДГ в вентральную область гиппокампа мышам снижало количество эпизодов забывания в Go-no-Go тестировании в сравнении с группой контроля. Кроме того, введение АДГ увеличивало количество волн тета-ритма на ЭЭГ. Именно данный вид волн ассоциирован с консолидацией памяти, что также позволяет предположить прямое участие вазопрессина в формировании памяти.
Браттлеборо крысы как модель дефицита АДГ
Браттлеборо крысы – это линия крыс, имеющих генетическую мутацию в виде в гене нейрофизина. Нейрофизин – это предшественник АДГ, и нарушение его синтеза у данных крыс ведет к отсутствию биологически активного вазопрессина в ЦНС. Однако данные из других исследованию показали, что АДГ может синтезироваться в периферических органах, таких как печень, почки, прямая кишка, и, следовательно, данная линия крыс не является полностью нокаутной по данному гену. Тем не менее, в их крови отмечается отсутствие АДГ, что вело к развитию несахарного диабета, проявляющегося синдромом полидипсии-полиурии.
Данный вид крыс считается наиболее подходящим для изучения эффектов АДГ в ЦНС, поскольку, помимо несахарного диабета, у них наблюдаются нарушения памяти и сна. При ЭЭГ исследовании у мышей, нокаутных по гену нейрофизина, наблюдалось преимущественное бодрствование вместо поверхностного сна в одной из фаз, а также укорочение REM-фазы.
Проблемы с памятью у данных мышей выявлялись при помощи тестов пассивного и активного избегания. Более быстрая потеря приобретенных навыков по сравнению с группой контроля нивелировалась подкожным введением АДГ. Помимо ассоциативной памяти, у животных наблюдается также нарушение узнавания и дефицит социальной памяти.
ЭЭГ также позволило диагностировать нарушения памяти. В норме тета-волны, характерные для бодрствования и REM фазы, ассоциированы с обучением и запоминанием. Тета-волны отражают организацию гиппокампа во время обучения новой информации, необходимую для её запоминания. Во время теста на узнавание новых объектов контроль с помощью ЭЭГ показал меньшее количество тета-ритмов у крыс Браттлеборо по сравнению с контрольной группой, при этом результаты теста у исследуемых животных также были значительно ниже.
Таким образом, экспрессия вазопрессина в ЦНС вариативна в течение суток, что позволяет предположить его роль в циркадных ритмах. Исследования на крысах Браттлеборо, а также клинические исследования с участием людей показали значительную зависимость функций памяти и качества сна от уровня АДГ. Несмотря на большое количество исследований, выделить единую функцию АДГ в формировании памяти и управлении сном в настоящее время затруднительно ввиду противоположности результатов ряда исследований.
Источник: Török B., Varga J., Zelena D. Vasopressin as a Possible Link between Sleep-Disturbances and Memory Problems // Int. J. Mol. Sci. 2022. Vol. 23, № 24. P. 15467.
Перевод подготовила Шадеркина Анастасия (команда Доквей), Сеченовский университет, Москва.




