НЕ РЕКЛАМА! Лекарственная устойчивость и новый антибиотик
В 2019 году 4,95 миллиона смертей во всем мире были связаны с устойчивостью бактерий к противомикробным препаратам. Если эта тенденция сохранится и не появятся новые лекарства для лечения бактериальных инфекций, то к 2050 году 10 миллионов человек будут умирать каждый год от устойчивости к противомикробным препаратам.
Новый антибиотик под названием кловибактин вселяет надежду в борьбе с лекарственной устойчивостью.
Этот препарат, выделенный из бактерий, которые ранее не изучались, по-видимому, способен бороться с «супербактериями» с множественной лекарственной устойчивостью благодаря необычным механизмам действия.
Препарат был обнаружен и изучен учеными из Утрехтского университета в Нидерландах, Боннского университета в Германии, Немецкого центра исследований инфекций, Северо-Восточного университета в Бостоне и компанией NovoBiotic Pharmaceuticals в Кембридже, штат Массачусетс.
Их исследование было опубликовано онлайн в Cell.
Исследователи выделили кловибактин из песчаной почвы Северной Каролины и изучили его с помощью устройства iCHip, которое было разработано в 2015 году. Этот метод позволил им вырастить «бактериальную темную материю», так называемые некультивируемые бактерии, составляющие группу, в которой 99% принадлежит бактериям.
Это устройство также проложило путь к открытию антибиотика тейксобактина в 2020 году. Тейксобактин эффективен против грамположительных бактерий и является одним из первых по-настоящему новых антибиотиков за последние десятилетия. Механизм его действия аналогичен механизму действия кловибактина.
В своей статье исследователи показали, что кловибактин действует через несколько механизмов и он успешно лечит мышей, инфицированных супербактерией Staphylococcus aureus.
Кловибактин проявлял антибактериальную активность в отношении широкого спектра грамположительных патогенов, включая устойчивые к метициллину, даптомицину и ванкомицину штаммы S.aureus, а также трудно поддающиеся лечению устойчивые к ванкомицину Enterococcus faecalis и E. faecium. Escherichia coli подавлялась незначительно по сравнению со штаммом E.coli WO153 с дефицитом внешней мембраны, что, вероятно, отражает недостаточное проникновение соединения.
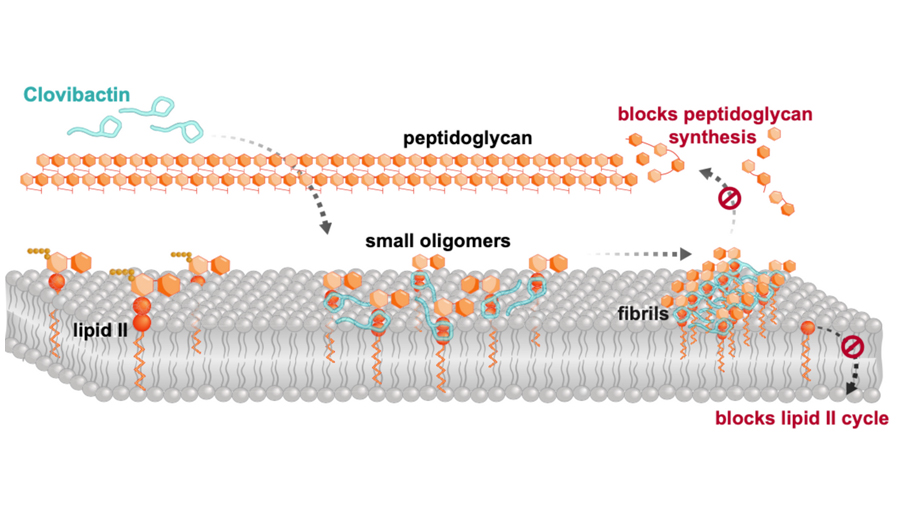
Кловибактин действует не на одну, а на три молекулы, каждая из которых необходима для построения бактериальных стенок: C55PP, липид II и липид IIIWTA, которые происходят из разных путей биосинтеза клеточной стенки. Кловибактин связывается с пирофосфатной частью этих предшественников.
Замечательным аспектом механизма действия кловибактина является то, что он связывается только с неизменяемым пирофосфатом, который является общим для предшественников клеточной стенки, но он также игнорирует вариабельную сахаропептидную часть мишеней. Поэтому бактериям гораздо труднее выработать устойчивость к нему. «Фактически, в наших исследованиях мы не наблюдали никакой устойчивости к кловибактину», — подтвердили авторы.
Связывая молекулы-мишени, он самоорганизуется в крупные фибриллы на поверхности бактериальных мембран. Эти фибриллы стабильны в течение длительного времени и тем самым гарантируют, что целевые молекулы остаются изолированными столько времени, сколько необходимо для уничтожения бактерий.
Из-за механизма действия антибиотика прогнозируется низкая частота побочных эффектов. Действительно, кловибактин нацелен на клетки бактерий, но не на клетки человека.
Прежде чем антибиотик можно будет рассматривать в качестве потенциального лечения, необходимы другие исследования, в частности, исследования на людях. В то же время, правила, касающиеся надлежащего использования антибиотиков, должны продолжать применяться для ограничения устойчивости к антибиотикам.
Источник: https://www.medscape.com/viewarticle/996504
Статья переведена и адаптирована Красняк И.В. (команда Доквей).



